Под действием тепла белки мяса и рыбы изменяются следующим образом. Уже при температуре около 40° начинается денатурация белков мяса.
Большая часть их денатурируется при 65—68°. При 55—60° сваривается коллаген. Мышечные волокна сжимаются, продукт теряет влагу. При температуре около 70° денатурируются миоглобин и гемоглобин, мясо приобретает сероватую окраску (если к нему при посоле не добавлены селитра или нитриты). Большая часть белков рыбы денатурируется при 75—80°.
При достаточно длительном воздействии тепла в результате гидролиза коллагена размягчается соединительная ткань, вследствие чего ослабляется связь между мышечными пучками, мышечная ткань становится сравнительно мягкой, приобретая определенную степень кулинарной готовности.
Мышечные волокна представляют собой сложную многокомпонентную систему, в которой белки, находящиеся в состоянии геля, пропитаны золем, содержащим миоген, глобулин и азотистые и безазотистые экстрактивные вещества в соли. В результате денатурации белков коагулирует золь, уплотняется гель, вследствие чего часть влаги, содержащаяся в них, вытесняется, уменьшается объем, повышается удельный вес продукта и pH сдвигается в щелочную сторону.
Аналогично коагулируют и белки рыбы, с той лишь разницей, что плотный гель образуется раньше, чем при коагуляции белков мяса. С повышением температуры увеличивается плотность геля и количество выделяемой им влаги.
При воздействии тепла наряду с выделением влаги из мышечной ткани коллаген соединительной ткани и образующийся из него глютин поглощают некоторое количество влаги. Особенно отчетливо это показано. Лобановым в опытах с мясом рыбы. Поглощение воды коллагеном подтверждается гистологическими изменениями соединительной ткани в процессе тепловой обработки.
При увеличении температуры и продолжительности теплового воздействия коллаген соединительной ткани переходит в водорастворимый глютин, вследствие чего резко снижается механическая прочность соединительной ткани и быстрее достигается кулинарная готовность продукта. Скорость превращения коллагена различных видов и сортов мяса в глютин неодинакова. В частности, она зависит от морфологической структуры соединительной ткани.
Степень кулинарной готовности, и особенно консистенция мясных или рыбных продуктов, зависят главным образом от двух факторов, действующих в противоположном направлении: денатурации белков, повышающей жесткость, и изменения соединительной ткани, способствующего размягчению продукта.
В рыбе и рыбных продуктах соединительная ткань изменяется быстрее, поэтому кулинарная готовность их достигается уже в процессе горячего копчения, при котором фактически одновременно происходит осаждение коптильных компонентов дыма и проваривание (пропекание) продукта.
Соединительная ткань мясных продуктов медленнее размягчается, поэтому после копчения некоторые продукты (например, окорок) необходимо подвергать дополнительной тепловой обработке (варке в воде, паром),
Во время копчения, помимо размягчения соединительной ткани, происходит повышение прочности ее, обусловленное дублением белков (преимущественно в поверхностном слое) под действием некоторых коптильных компонентов дыма.
Из коптильных компонентов дыма самыми сильными дубящими свойствами обладает формальдегид. Эти свойства его проявляются даже в парообразном состоянии. Дубящие свойства обнаружены также у уксусного альдегида и акролеина. Фурфурол, кетоны, а также одноядерные фенольные соединения (фенол, крезолы, орто-мета- и оксибензолы, пирогаллол и пр.) дубящими свойствами не обладают. Однако фенолы могут взаимодействовать с коллагеном, способствуя набуханию и понижению термостойкости его. Выраженными дубящими свойствами обладают только некоторые продукты конденсации фенолов с альдегидами типа фенолформальдегидных смол.
Формальдегид взаимодействует не только с коллагеном, но и с другими белками как волокнистой, так и глобулярной структуры.
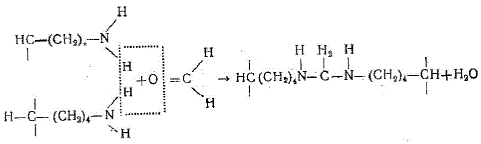
Механизм дубления полностью еще не выяснен. Считают, что дубящие свойства формальдегида обусловлены образующимися при взаимодействии его с аминогруппами остатков лизина или оксилизина метиленовыми мостиками, например:
Известно, что в результате дубления белков шкуры животных повышается их стойкость к нагреванию и к химическим и ферментативным воздействиям; увеличивается прочность; сохраняется пористость во время сушки.
Можно предполагать, что аналогично в результате дубления изменяются и свойства белков копченых продуктов. О правильности этого положения свидетельствует, например, содержание в копченом рыбном филе связанного формальдегида.
Благодаря повышению стойкости белков к нагреванию и увеличению механической прочности коллагена соединительной ткани, образующей кожный покров (дерму) рыб, лучше сохраняется форма продукта, не происходит чрезмерного разваривания сравнительно нежного мяса рыб и отслаивания дермы от мяса. Экспериментами установлено увеличение сопротивления на, разрыв мышечной ткани килек, обработанных дымом по сравнению с контрольным образцом. Аналогичные явления наблюдаются при обработке колбас в натуральной оболочке.
При нарушении режима копчения, например при слишком быстром повышении температуры в коптильной камере, коллаген соединительной ткани гидролизуется; прочность его резко снижается прежде, чем произойдет дубление белков. В результате этого рыба может срываться с вешал.
Благодаря, сохранению продубленным слоем белковых веществ пористости равномерно удаляется влага при длительной сушке сырокопченых колбас в натуральных оболочках. В результате повышения стойкости дубленых кишечных оболочек к воздействию тепла и влаги и сохранения ими эластичности (в случае альдегидного дубления) не нарушается целостность колбасных батонов при тепловой обработке и обеспечивается хороший внешний вид (без складок и морщин) при хранении (варёные колбасы, сосиски и т. п.). Эти свойства, коптильного дыма и продуктов пиролиза древесины (подсмольной воды) используют при изготовлении искусственных белковых оболочек для колбас.
Химические изменения в продуктах холодного копчения обусловлены ферментативными изменениями в самом продукте и в результате жизнедеятельности микроорганизмов. Как правило, копчение осуществляется при более высоких температурах, чем предшествующая обработка, что способствует усилению химических реакций в продукте. Несомненно, что коптильные компоненты дыма, обладающие дубящими, коагулирующими и бактерицидными свойствами, влияют на химические изменения в продукте, однако взаимосвязь этих явлений изучена еще недостаточно.
При холодном копчении рыбы содержание небелкового азота увеличивается в среднем в 1,5 раза, аминного в 1,8 раза, что свидетельствует о частичном расщеплении белковых веществ.
Химические изменения в сырокопченых колбасах аналогичны изменениям, протекающим в мясе при посоле и сушке, но выражены более отчетливо.
Изменения мяса, связанные с денатурацией белков, начинаются еще в процессе осадки. Об этом свидетельствует уменьшение количества солерастворимых белков.
Это подтверждается также данными физико-химических исследований, на основании которых установлено, что в процессе копчения эластичность и влагопоглощаемость фарша сырокопченых колбас понижается, а липкость его падает до 0.
Базарова и Крылова, пользуясь методом изотопов, нашли, что при изготовлении сырокопченых колбас изменения, связанные с повышением химической активности функциональных групп белков, начинаются во время копчения, усиливаясь после сушки. Авторы считают, что указанные изменения обусловлены воздействием составных частей дыма и уменьшением содержания влаги в продукте.
Изменения, вызываемые нагревом при горячем копчении и обусловленные главным образом денатурацией белков, сводятся к следующему: исчезает «сырой» вкус и появляется вкус вареного продукта, размягчается соединительная ткань, изменяется цвет. Необходимо, однако, при этом учитывать интенсивность и длительность теплового воздействия на белки.
Вопрос, какой режим обработки горячим дымом является наилучшим с учетом сохранения пищевой ценности копченого продукта, приобретает актуальность в связи с работами по интенсификации процесса копчения путем применения высоких температур.
Нижний предел теплового воздействия на продукт определяется необходимой степенью денатурации мышечных белков. Практически денатурация мышечных белков, в том числе и миоглобина, завершается при температуре 70—80°.
Наличие в мясе и рыбе белков соединительной ткани, от изменения которых в значительной степени зависит их консистенция, обусловливает необходимость такого режима тепловой обработки, при котором основной белок соединительной ткани — коллаген — переходит в глютин.
Продукты, содержащие коллаген, легко поддающийся действию тепла и влаги (например, рыба, мясо молодых животных), так же, как и продукты, в которых соединительная ткань подготовлена к более быстрым изменениям (измельченное мясо — фарш для колбас и сосисок), необходимо подвергать умеренной тепловой обработке. Практикой колбасного производства установлено, что в этом случае вполне достаточна тепловая обработка, в результате которой температура внутри колбасных батонов достигает 68—72°.
По мнению Тильгнера, лишь для рыбных продуктов, выдерживаемых в посоле, приемлемо достижение температуры в толще их 70—75°. В связи с этим он считает, что при горячем копчении рыбы нижний предел теплового воздействия должен обеспечивать внутри продукта температуру, равную 76°.
Не менее важно определение верхнего температурного предела, т. е. температуры, до которой можно нагревать продукты без снижения качества.
При кратковременном воздействии тепла и температуре ниже 100° необратимые изменения белков носят скорее физико-химический характер (внутримолекулярные перегруппировки), чем характер химического распада белковых молекул.
При более интенсивном воздействии (повышении температуры, значительном увеличении продолжительности процесса) происходят существенные химические изменения белков, более заметно отражающиеся на вкусе и пищевых достоинствах продукта.
Это подтверждается следующими данными об образовании сероводорода в мясе, подвергаемом тепловому воздействию в течение 60 мин:
| Температура в град. | 70 | 80 | 90 | 100 |
| Количество H2S в мг на 100 г мяса | Следы | 0,04 | 0,27 | 0,80 |
Основываясь на имеющихся в литературе сведениях о термической, дезагрегации белков, Тильгнер в Питржик пришли к выводу, что максимальная температура, до которой можно нагревать продукт при горячем копчении рыбы, должна быть не более 82°. Выше этой критической температуры происходят значительные изменения белков, вследствие чего ухудшаются консистенция, цвет, аромат и вкус продукта. При этом Тильгнер и Питржик допускают возможность применения более высокой температуры коптильной среды на стадии подсушивания рыбы, имея ввиду, что испарение влаги из продукта предохраняет его от нежелательного перегрева.
По мнению Тильгнера, максимально допустимая температура поверхности копченых продуктов не должна превышать 90°. Долежал, сравнивавший качество свиной чешской колбасы, обработанной дымом при различных температурах (79—103°), нашел, что предельно возможным является нагревание до 80°. В результате указанных изменений рыба теряет устойчивость к механическому воздействию. После охлаждения рыба горячего копчения становится более плотной вследствие застудневания глютина. При более высоких температурах из колбасы начинает вытапливаться жир, вытекает мясной сок, поверхность ее становится сморщенной, качество резко ухудшается. При низкой температуре дыма также получается недостаточно качественный продукт (по окрашиванию, ароматичности, консистенции). По данным Долежала, при копчении (обжарке) вареных колбасных изделий типа кабанос в условиях небольшой относительной влажности (39%) оптимальной является температура дыма 85—92°.
