Среди органоидов растительной клетки хлоропласты (от греч. хлорос — зеленый, пластос — образование) играют исключительно важную роль, потому что в них осуществляется процесс фотосинтеза. Очень немногие физиологические процессы столь же явно связаны с определенными органоидами клетки, как фотосинтез с зелеными пластидами.
Познание сложной структуры хлоропластов, а также тех изменений, которые они претерпевают под влиянием различных условий произрастания растений, содействует разгадке тайн фотосинтеза и открывает пути активного управления этим процессом.
Форма пластид
У разных видов растений хлоропласты неодинаковы по форме, размерам и строению. Особым богатством форм отличаются пластиды (хроматофоры) водорослей. Они могут быть звездообразными, спиральными, в виде дисков, пластин, полос и т. д. Так, например, у водоросли зигнемы (Zygnema) имеются звездообразные хроматофоры, у мужоции (Mougeotia) — пластинчатые, у спирогиры (Spirogyra) они в виде спирально скрученных лент. Одноклеточная водоросль хлорелла (Chlorella), широко применяемая в исследованиях по фотосинтезу, имеет один колоколовидный хроматофор. У высших растений полностью сформированные хлоропласты, или хлорофилловые зерна, мало отличаются по форме, напоминая обычно семена чечевицы или двояковыпуклую линзу.
Структура хлоропластов
Структурные и функциональные особенности хлоропластов тесно связаны между собой, об этом, в частности, свидетельствует тот факт, что условия, вызывающие изменения их структуры, также оказывают существенное влияние и на фотосинтез.
В последнее время ввиду успехов в изучении функций пластид в значительной степени повысился интерес к их субмикроскопической структуре. Исследования субмикроскопического строения органоидов клетки, в том числе пластид, стали возможными только благодаря применению электронных микроскопов с большой разрешающей способностью, близкой к 5—8 ∙ 10-10 м (5—8 Å), а также усовершенствованию техники изготовления ультратонких срезов растительных тканей.
Электронно-микроскопические исследования хлоропластов ведутся в широких масштабах уже более 10 лет, и к настоящему времени накопилось значительное количество сведений, позволяющих расшифровывать их структуру на молекулярном уровне, чего, конечно, нельзя было делать на базе данных, полученных с помощью светового микроскопа. Возникли принципиально новые представления о строении одних из важнейших функциональных структур растительной клетки, осуществляющих процесс фотосинтеза. Удалось также установить, что отдельные реакции фотосинтеза связаны с определенными структурными элементами хлоропластов. Однако, несмотря на большие успехи в этой области, вопрос о субмикроскопическом и молекулярном строении хлоропластов далек еще от своего разрешения. Это видно хотя бы из того, что до сих пор нет единой общепризнанной схемы строения не только хлоропласта в целом, но и отдельных его структурных элементов, например ламелл. По мере совершенствования методов исследования, безусловно, будут расширяться и углубляться наши знания о структуре этих органоидов.
Анализ данных, полученных с помощью электронного микроскопа, показывает, что хлоропласта представляют собой высокоспециализированную биологическую функциональную структуру, имеющую у разных видов растений принципиально сходное строение. Вместе с тем у растений, принадлежащих к разным систематическим группам, наблюдается большое разнообразие сочетаний отдельных структурных элементов. Кроме этого, сочетание отдельных структурных элементов определяется индивидуальным развитием растений, экологическими условиями произрастания и рядом других условий.
По современным представлениям, полностью сформировавшиеся хлоропласты у высших растений построены из таких основных элементов, как оболочка, матрикс (или строма), граны и межгранные ламеллы. Все эти элементы хорошо видны на электронной микрофотографии.

Хлоропласт листа огурца (фикс. KMnO4) (по И. М. Кислюку и В. Ф. Машанскому): Г — грана; МГ — межгранные ламеллы; С — строма; М — митохондрия
Еще совсем недавно считалось, что хлоропласты лишены какой-либо оболочки и представляют собой «сгущения» цитоплазмы. Электронно-микроскопические исследования ультратонких срезов, проведенные разными учеными, с несомненностью доказали наличие оболочки у хлоропластов. Таким образом, был окончательно решен остававшийся до последнего времени дискуссионным вопрос о степени обособленности хлоропластов в клетке.
Установлено, что хлоропласты покрыты, как правило, двойной оболочкой, являющейся по своей химической природе липопротеидной (липопротеиды — это соединения белков с липидами, т. е. с жирами и жироподобными веществами). У некоторых водорослей хлоропласты окружены не двух-, а многослойными оболочками. Из высших растений лишь иногда у кукурузы обнаруживаются хлоропласты с четырехслойными оболочками.
Толщина оболочек хлоропластов у разных растений неодинакова. В частности, двухслойная оболочка у кукурузы имеет толщину около 200 ∙ 10-10 м (200 Å), а у огурца — около 100 ∙ 10-10 м (100 Å), причем наружная и внутренняя мембраны оболочки могут находиться друг от друга также на разном расстоянии, например у табака — на расстоянии 100—300 ∙ 10-10 м (или от 100 до 300 Å). Оболочка не сплошная, она пронизана отверстиями (порами). Вероятно, благодаря наличию пор в оболочке, а также ее способности адсорбировать на своих поверхностях мелкие структуры цитоплазмы и матрикса она играет важную роль в процессах обмена веществ между хлоропластом, цитоплазмой и другими органоидами клетки, а следовательно, и в установлении тесной связи хлоропласта с ними.
Внутреннее строение вполне сформировавшегося хлоропласта представляет собой систему структур, образованных ламеллами, иначе говоря пластинками, и поэтому называемых пластинчатыми или ламеллярными структурами. Пластинчатость строения характерна не только для гран, но и для межгранных участков. Ламеллярные структуры погружены в основное белковое вещество — матрикс. Интересно отметить, что ламеллярное строение хлоропластов удалось обнаружить еще с помощью светового микроскопа, а затем оно было подтверждено электронно-микроскопическими исследованиями. Особенно плодотворным оказалось применение методики ультратонких срезов, позволившей изучать внутреннее строение хлоропластов, т. е. взаимное расположение структурных элементов, и в частности расположение гранных и межгранных ламелл.
Основной структурной и функциональной единицей хлоропласта большинством ученых признается диск. Диски образуются из параллельно лежащих ламелл, которые соединяются попарно между собой. Диски похожи на замкнутые сплющенные мешочки, и поэтому их часто называют тилакоидами (от греч тилакоидес — мешковидный). У низших растений в строму погружены отдельные тилакоиды или пачки плотно прижатых друг к другу тилакоидов. У высших растений хлоропласта имеют более сложную структуру, для которой характерно наличие гран. Довольно широкое признание получило представление о том, что граны состоят из отдельных дисков или их участков, строго расположенных друг над другом наподобие стопки монет. Граны не изолированы, они соединяются друг с другом при помощи межгранных ламелл, образуя единую высокоупорядоченную структуру.
Рассмотрим кратко некоторые наиболее распространенные и перспективные схемы ламеллярно-гранулярного строения хлоропластов. Согласно схеме Д. Веттштейна сплошные диски проходят через весь хлоропласт, отделяясь слоями стромы. В некоторых местах ламеллы дальше удалены друг от друга и имеют большую толщину. Располагаясь друг над другом, такие утолщенные участки дисков и образуют граны.
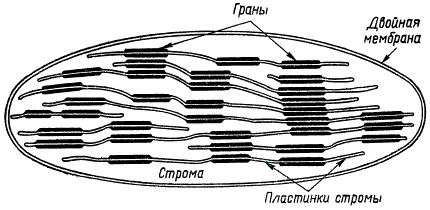
Схема строения хлоропласта (по Д. Веттштейну)
А. Ходж наблюдал в хлоропластах кукурузы вдвое меньшее количество межгранных ламелл по сравнению с числом ламелл гран. Основываясь на этих данных, он разработал схему, показывающую, что межгранные ламеллы, раздваиваясь в определенных местах и плотно прилегая друг к другу, образуют граны.
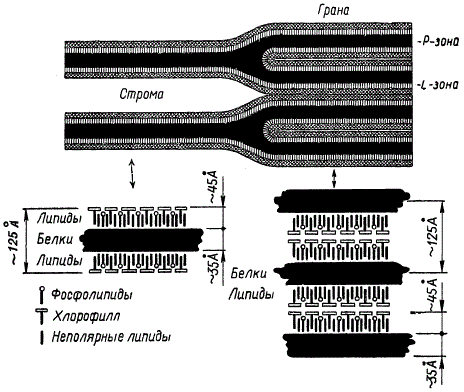
Схема строения ламелл и гран (по А. Ходжу): Р — белковый слой; L — липидный слой
В построении гран, как это видно на схеме И. М. Кислюка и В. Ф. Машанского, принимают участие и собственно гранные и межгранные диски, имеющие большую длину, чем первые. Межгранные диски могут пересекать граны, а могут входить в них только с одной стороны; правильного чередования гранных и межгранных дисков нет.
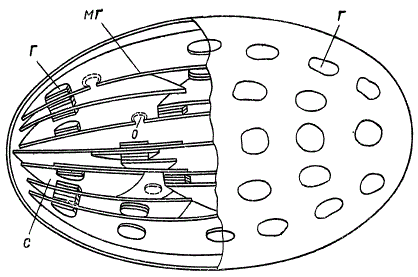
Схема строения хлоропласта (по И. М. Кислюку и В. Ф. Машанскому): Г — грана; МГ — межгранная ламелла; С — соединение дисков; О — отверстие в межгранной ламелле
Сравнительно недавно Т. Вейер выдвинул гипотезу гранулярно-сетчатой структуры хлоропластов, по которой основной структурной единицей является не диск, а грана. Граны представляют собой цилиндры, разделенные на отдельные отсеки — капсулы. Ламеллы стромы не принимают участия в построении гран; они имеют вид ветвящихся трубочек, которые сливаются друг с другом. При помощи системы таких трубочек граны соединяются между собой, в результате чего образуется трехмерная гранулярно-сетчатая структура, изображенная схематически на рисунке. Благодаря своей извилистости трубочки могут изменять расположение гран внутри хлоропласта под влиянием разных условий освещения, что содействует лучшему поглощению световой энергии. Эти интересные предположения о роли трубчатых систем, как и сама гипотеза о гранулярно-сетчатой структуре хлоропластов, нуждаются, безусловно, в дальнейшем экспериментальном обосновании.
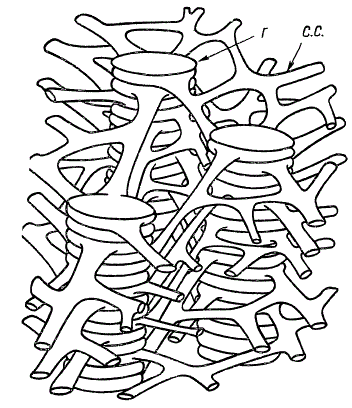
Трехмерная диаграмма гран с соединительной системой (по Т. Вейеру): Г — грана; С.С. — соединительная система
Краткий обзор нескольких схем внутреннего строения хлоропластов показывает, что до сих пор спорными остаются вопросы об основной структурной единице, о способах соединения ламелл гран с межгранными ламеллами и некоторые другие вопросы. Ни одна из приведенных схем не может, конечно, претендовать на единственно правильное отображение действительного строения хлоропластов.
Наряду с различиями, схемы имеют и много общего, говорящего в пользу того, что хлоропласта различных видов растений аналогичны в основных своих чертах. Последнее весьма вероятно, поскольку у всех растений хлоропласта выполняют одну и ту же функцию фотосинтеза. Несоответствие схем в деталях, по-видимому, можно отчасти объяснить различиями в физиологическом состоянии хлоропластов во время их исследования, а также тем, что электронный микроскоп дает только двухмерное изображение и при разработке трехмерной модели строения пластид неизбежен субъективный подход. Следует также учитывать, что электронно-микроскопические исследования в широких масштабах начались совсем недавно. И хотя уже накоплен очень большой фактический материал, полученный многими учеными в разных странах мира, за столь короткий промежуток времени весьма трудно было осмыслить, проанализировать и обобщить огромное количество экспериментальных данных.
Дальнейшие исследования с применением более совершенных методов, а также глубокий анализ результатов позволят, безусловно, разработать вполне обоснованную схему внутреннего строения хлоропластов.
Электронно-микроскопические фотографии срезов хлоропластов выявили трехслойную структуру ламелл. С помощью химических анализов удалось установить состав этих трех слоев и количественные соотношения между отдельными компонентами, а также показать, что ламеллярная система состоит в основном из сложных пигментно-липопротеидных комплексов, включающих пигменты, липиды и белки. На основании данных о трехслойной структуре ламелл и их химическом составе были предприняты попытки расшифровать строение ламелл на молекулярном уровне.
Одной из таких попыток была схема А. Ходжа, которая получила широкое распространение и часто описывается в отечественной научной и учебной литературе. Темные полосы на схеме изображают расположение белкового компонента (P-зона) в сложном хлорофилл-липопротеидном комплексе, а заштрихованные полосы соответствуют молекулярной структуре комплекса, состоящего из молекул хлорофилла, неполярных липидов и фосфолипидов. Белковый слой (P-зона) толщиной в 35∙10-10 м (35 Å)с обеих сторон покрыт симметрично расположенной пленкой из хлорофилл-липидов (L-зона), имеющей толщину 45∙1010 м (45 Å).
По мере накопления новых данных схема А. Ходжа развивалась и совершенствовалась другими учеными. В частности, М. Кальвин изменил взаимное расположение слоев в структуре ламеллы: вместо двух хлорофилл-липидных слоев в его модели имеется один пигментно-липидный слой. Этот слой обладает полярным строением и располагается между двумя белковыми слоями.
За последнее время в изучении структуры хлоропластов были достигнуты особенно большие успехи благодаря применению новых методов изготовления препаратов, таких, как напыление, снятие реплик с быстро замороженного материала при температуре —150° С, озвучивание ультразвуком для раздробления на фрагменты, дифференциальное центрифугирование и др. Было обнаружено, что поверхность ламелл имеет не гладкослоистое, как считали раньше, а зернистое строение из-за наличия ультраструктур глобулярного типа, т. е. структур, имеющих шарообразную форму (от лат. глобулюс — шарик).
При сопоставлении результатов электронно-микроскопических исследований, полученных разными методами, возникает вопрос, почему на срезах, фиксированных OsO4 и KMnO4, не удается наблюдать глобулярные структуры. По мнению некоторых исследователей, глобулярность структуры ламелл тилакоидов наблюдается только тогда, когда препараты изготовляются без использования фиксирующих и обезвоживающих реактивов. В этом случае сохраняется третичная структура белков, определяющая тип скручивания цепи данного белка. Благодаря скручиванию молекулы многих белков хотя и состоят из длинных полипептидных цепей, тем не менее имеют почти шарообразную форму и поэтому называются глобулярными белками.
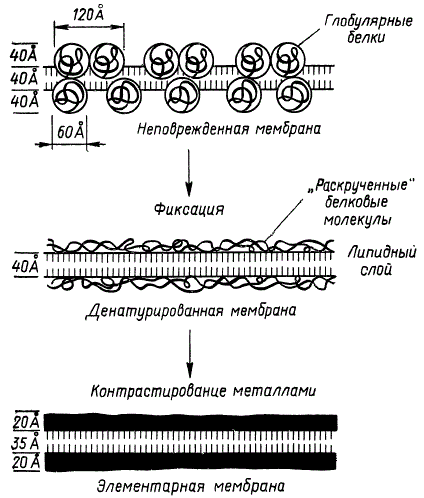
Схема строения фотосинтетической ламеллы (по К. Мюлеталеру с соавторами)
Очень часто, для того чтобы увеличить контраст, т. е. четкость электронно-микроскопических изображений, объект фиксируют реактивами, содержащими тяжелые металлы. Такими реактивами являются четырехокись осмия, фосфорновольфрамовая кислота, фосфорномолибденовая кислота и т. п. Однако фиксация и обезвоживание приводят к денатурации глобулярных белков, т. е. к разрушению третичной структуры вследствие разрыва водородных и дисульфидных связей. Это, в свою очередь, вызывает раскручивание молекул глобулярных белков и переход их в прямолинейно вытянутые структуры. В связи с этим на фиксированных препаратах белковые слои имеют значительно меньшую толщину. На рисунке приведена схема, поясняющая процесс перехода глобулярных белковых структур ламелл гран в состояние «раскрученных» белковых молекул. Слои «раскрученных» белковых молекул обычно хорошо различаются на фиксированных срезах, имея вид сплошных темных полос в результате контрастирования их тяжелыми металлами. На рисунке эти слои изображены в виде черных полос.
Американские ученые Р. Парк и Н. Пон наблюдали зернистое строение не только гранных, но и межгранных ламелл. Они изучали фрагменты хлоропластов биохимическими методами, а также под электронным мш кроскопом методом напыления и получили фотографии ламелл, на которых хорошо различимы сферические частицы, расположенные правильными рядами. Диаметр этих частиц около 200 ∙ 10-10 м (200 Å), а высота около 100 ∙ 10-10 м (100 Å). Правда, позже размеры этих частиц были уточнены: оказалось, что толщина их 100, ширина 155, а длина 185 Å.

Электронная микрофотография граны хлоропласта шпината (по Р. Парку и Н. Пону)
Отсюда возникло новое представление о том, что в составе ламелл имеются упорядоченно расположенные глобулярные ультрачастицы, которые были названы квантосомами. Некоторые считают, что квантосомы соответствуют в физиологическом отношении фотосинтетической единице.
На основании представлений о квантосомах как о структурных и функциональных единицах фотосинтетического аппарата Р. Парк и Н. Пон предложили оригинальную схему строения гранных и межгранных ламелл. На ней квантосомы размещены в ряд на внутренней поверхности ламелл и частично вдаются в полость дисков (или тилакоидов), где квантосомы одной ламеллы заполняют впадины, имеющиеся между квантосомами другой, противолежащей ламеллы (на схеме квантосомы одной из ламелл изображены пунктирными линиями, а другой ламеллы — сплошными линиями). На основании новых экспериментальных данных стали предполагать, что квантосомы располагаются не с внутренней, а с наружной стороны тилакоидов. Недавно удалось выделить квантосомы из листьев шпината в виде фракции зеленых частиц, представляющих собой сплющенные у полюсов элипсоиды, состоящие из пигментно-липопротеидных комплексов.
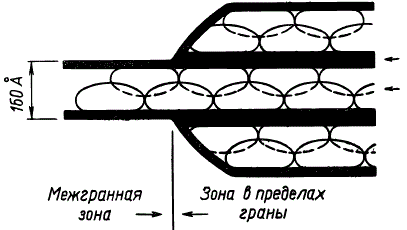
Схема строения гранных и межгранных ламелл (по Р. Парку и Н. Пону)
В настоящее время предпринимаются попытки представить пространственное расположение молекул в квантосоме с учетом полученных путем биохимических анализов данных о количественном содержании в них отдельных компонентов. Рисунок, схематически изображающий строение квантосом ламелл хлоропластов кукурузы, показывает, что они состоят из компонентов пигментно-липопротеидного комплекса. Такие компоненты этого комплекса, как хлорофилл, каротиноиды и фосфолипиды, располагаются по сферической поверхности квантосомы, окруженной полипептидным (белковым) слоем. В центре квантосомы находится липопротеидный комплекс.
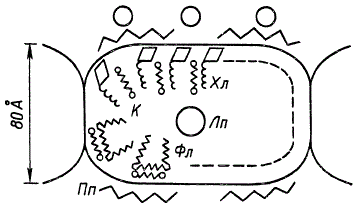
Схема строения квантосомы (по Жиро): Хл — хлорофилл; Лп — липопротеидный комплекс; Пп — полипептиды; К — каротиноиды; Фл — фосфолипиды
Имеются данные, свидетельствующие и о различиях между гранными и межгранными ламеллами. В частности, было обнаружено, что поверхность дисков гран гуще покрыта квантосомами, чем поверхность межгранных ламелл. На основании этого некоторые ученые делают заключение о том, что граны более дифференцированы в функциональном отношении и, следовательно, играют большую роль в фотосинтетической деятельности хлоропластов, чем межгранные ламеллы. Хорошо известен и такой экспериментально установленный факт, как неодинаковая механическая прочность разных ламелл. Гранине ламеллы отличаются значительной механической прочностью, благодаря чему они сохраняются в гранах или встречаются в отдельных дисках при центрифугировании, действии ультразвука или при умеренном набухании, тогда как в этих же самых условиях межгранные ламеллы полностью разрушаются.
Граны образуются на определенном этапе формирования хлоропласта и могут включать от 2 до 50 дисков. Обычно в полностью сформировавшемся хлоропласте высших растений содержится 20—200 гран и даже больше. Например, в клетках листьев кукурузы каждый хлоропласт содержит 50—200 гран, довольно однородных по форме и близких по размерам. У шпината количество гран колеблется незначительно — в каждом хлоропласте их 40—60. Диаметр гран (в сухом состоянии) 0,5—1 мкм (мкм — микрометр, или микрон, равен 1 ∙ 10-6 м), а высота 0,1—0,2 мкм. Объем одной граны колеблется от 0,03 до 0,1 мкм3. На протяжении жизни листа изменяются не только размеры хлоропласта, гран, но и той его доли, которая приходится на граны. В качестве примера приведем данные, полученные А. А. Табенцким для хлоропластов листьев сахарной свеклы.
Изменение размеров хлоропластов и гран в листьях сахарной свеклы
| Лист | Размер хлоропластов, мкм | Размер гран, доли хлоропластов | Размер гран, мкм |
| Очень молодой, желтый, еще не развившийся | 1,4 | — | — |
| Желтоватый, развернувшийся | 4,2—4,9 | 1/12—1/15 | 0,35—0,33 |
| Растущий, зеленый, блестящий | 5,6—6,3 | 1/10—1/12 | 0,56—0,53 |
| Закончивший рост | 5,6—7,0 | 1/8—1/10 | 0,70—0,70 |
| Серо-зеленый | 4,9—5,6 | 1/8—1/10 | 0,61—0,56 |
| Отмирающий, с желтыми тонами | 3,5—4,2 | 1/6—1/8 | 0,58—0,52 |
В зависимости от условий произрастания растений соотношение между ламеллярными структурами и матриксом может существенно изменяться. Так, было установлено, что при полном естественном освещении у кукурузы матрикс составляет незначительную часть от массы всего хлоропласта, тогда как при затемнении (1/3 естественного освещения) на долю матрикса приходится уже половина хлоропласта. В настоящее время электронно-микроскопические исследования на фиксированных препаратах позволили рассмотреть структуру матрикса. В нем заметны своеобразные «структурные центры», в которых располагаются отдельные рибосомы и полирибосомы (полисомы), т. е. комплексы из нескольких рибосом, связанных воедино молекулой информационной рибонуклеиновой кислоты (и-РНК). Установлено, что рибосомы в виде плотных частиц размером 100—300 ∙ 10-10 м (100—300 Å) имеются в матриксе хлоропластов у мари белой, а в хлоропластах кливии, помимо матрикса, они находятся также на концах дисков гран.
Соотношение между количеством полирибосом и одиночных рибосом зависит от условий освещения. Полисомы появляются в хлоропластах только после некоторого периода освещения. Если же растение длительное время находится в темноте, то в его хлоропластах полисомы не обнаруживаются. В полисомах, как известно, осуществляется синтез белка в клетке, причем эту способность в соответствующих условиях сохраняют даже изолированные хлоропласта. Некоторые считают хлоропласта основным местом синтеза белка в клетках листа.
Кроме ламеллярных структур, в матриксе хлоропластов обнаруживаются еще особые образования, называемые разными исследователями по-разному: жировые (или липоидные) капельки, плотные сферические гранулы, осмиофильные гранулы, или глобулы. Осмиофильные глобулы имеются в матриксе самых разнообразных растений, а называются так потому, что они хорошо видны на препаратах, фиксированных четырехокисью осмия, в виде шаровидных частиц — глобул. Многие ученые считают, что основным веществом этих глобул являются липиды, так как именно липиды окрашиваются осмием гораздо интенсивнее, чем белки. Химический анализ глобул также показал, что они состоят главным образом из липидных компонентов. Однако глобулы, по-видимому, неоднородны в химическом отношении: помимо липидов, в их состав входят белки. Об этом свидетельствует следующий факт. Было подмечено, что при фиксации KMnO4 никогда не наблюдаются глобулы, но зато хорошо выявляются звездчатые частицы, которые обычно не видны при фиксации OsO4. На основании этого ряд исследователей делает вывод о том, что глобулы и звездчатые частицы — это одни и те же объекты. Они неоднородны по химическому составу и поэтому по-разному проявляются — в зависимости от фиксатора. Поскольку осмий интенсивно окрашивает жиры и гораздо слабее белки, а марганец оказывает противоположное действие, стали считать, что осмиофильные глобулы представляют собой липоидные шарики, внутри которых имеется белок, проявляющийся при фиксации KMnO4 в виде звездчатых частиц.
Д. Веттштейн, А. А. Шахов и другие полагают, что в состав глобул входят еще и пигменты (хлорофилл и каротиноиды либо только одни каротиноиды). Непосредственное определение химического состава осмиофильных глобул, выделенных из хлоропластов конских бобов и свеклы, выявило наличие пластохинона в глобулах. Эти данные заслуживают большого внимания, поскольку пластохинон играет важную роль в переносе электронов на световой фазе фотосинтеза, о чем подробнее будет говориться ниже.
Осмиофильные глобулы располагаются в матриксе без особого порядка (от нескольких штук до нескольких сотен в одном хлоропласте). В зависимости от вида, возраста и условий произрастания растения значительно изменяется не только количество, но и размеры глобул. Так, диаметр их колеблется в широких пределах — от 0,05 до 0,7 мкм, а к концу вегетации размеры могут увеличиваться в несколько раз. Появление осмиофильных глобул связано с ухудшением физиологического состояния и снижением фотосинтетической деятельности растения по мере его старения или в результате действия низких температур, ультрафиолетового облучения, недостатка некоторых элементов минерального питания, в частности железа. Особого внимания заслуживают данные о том, что разрушение структуры хлоропластов в результате возрастных изменений или под влиянием внешних условий, например исчезновение гран при недостатке железа, сопровождается резким увеличением количества и размеров осмиофильных глобул. Эти данные позволяют считать, что глобулы служат местами отложения веществ, высвобождающихся при разрушении фотосинтетических структур хлоропласта. После того как неблагоприятное внешнее воздействие, вызвавшее частичное разрушение фотосинтетического аппарата, прекратится, осмиофильные глобулы содействуют его восстановлению за счет содержащихся в них запасных веществ.
А. А. Шахов считает осмиофильные глобулы самостоятельными структурными единицами, играющими важную роль в процессах структурообразования хлоропласта и в перераспределении световой энергии по его отдельным элементам. Часть пигментов может переходить из гран в осмиофильные глобулы, в результате чего происходит частичное исключение из процесса фотосинтеза поглощенной хлоропластами световой энергии. В связи с этим при большом скоплении таких глобул в хлоропласте создаются неблагоприятные условия для фотосинтеза. Функции осмиофильных глобул, как и их химический состав, полностью еще не выяснены, а те интересные представления, которые высказаны по этим вопросам разными исследователями, нуждаются в дальнейшем экспериментальном подтверждении.
В матриксе хлоропластов могут накапливаться зерна первичного или ассимиляционного крахмала — одного из продуктов фотосинтеза. У многих водорослей зерна первичного крахмала или замещающих его других полисахаридов располагаются вокруг так называемых пиреноидов (от греч. пирен — косточка), которые, кроме водорослей, обнаружены еще только у некоторых печеночников.
Пиреноиды представляют собой образования, имеющие обычно шаровидную, а иногда палочковидную или даже неправильную форму. В зависимости от вида растений размеры пиреноидов колеблются от 1—3 до 15—18 мкм. Имеются данные о том, что их размеры могут увеличиваться по мере роста клетки. В участках хлоропласта, занятых пиреноидами, ассимиляции CO2 не происходит, но зато осуществляется превращение образовавшихся при фотосинтезе углеводов в крахмал или другие полисахариды. Поэтому пиреноиды можно рассматривать как специальные образования, обеспечивающие быстрый синтез крахмала из продуктов фотосинтеза, — углеводов. Электронно-микроскопическими исследованиями удалось обнаружить у пиреноида сеть трубочек, которыми он соединяется с ламеллярными дисками, расположенными между зернами крахмала. Весьма вероятно, что продукты фотосинтеза доставляются в пиреноид по этим трубочкам. Пиреноиды образуются из уже существующих аналогичных образований путем их деления, но могут возникать и заново. Однако последнее оспаривается некоторыми учеными.
Источник: Н.Н. Овчинников, Н.М. Шиханова. Фотосинтез. Пособие для учителей. Изд-во «Просвещение». Москва. 1972
