В середине 30-х годов для изучения структуры белков был применен новый метод — рентгеноструктурный анализ.
Если взять белок в кристаллическом виде и просветить его лучами Рентгена, то на фотопластинке получатся пятна. Каждое такое пятно будет означать присутствие отдельного атома в аминокислоте. Очищенный белок дает после просвечивания очень много пятен, число которых легко себе представить, если знать, что простейший пептид глицил-глицин дает их около 400. При анализе рентгенограмм ученые обращают внимание на регулярность расположения пятен, которая указывает на повторяемость структурных элементов в молекуле и на интенсивность почернения пятен. Используя сложный математический аппарат и электронносчетные машины, ученые смогли за несколько лет работы представить себе принцип строения молекулы и белка.
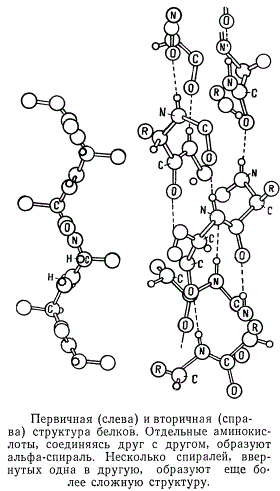
Вначале изучали отдельные пептиды. Предположим, мы получили точную схему строения продукта соединения двух глицинов. Мы можем химически присоединить к нашему дипептиду еще одну аминокислоту и получить трипептид. Само собой понятно, что пространственная структура третьей аминокислоты нам известна. На рентгенограмме появятся новые пятна, которые дают информацию об особенностях структурного расположения третьей аминокислоты относительно первых двух. Идя по такому пути, удалось установить принципы строения белковой молекулы.
Аминокислоты, располагаясь одна за другой вдоль полипептидной цепи, образуют спираль, которая, по имени открывших ее исследователей, получила название α-спирали Полинга и Кори. В одном витке α-спирали умещается 3,6 аминокислоты (или на 10 витков приходится 36 аминокислот), а толщина-спирали равна 10 Å. Спиральная структура белков получила название вторичной структуры.
Однако изучение отдельных белковых молекул под электронным микроскопом показало, что многие молекулы имеют толщину, превышающую 10 Å. Это происходит по двум причинам. Прежде всего, спирали соединяются вместе, образуя комплексы, причем одни вкручиваются в другие. Дальнейшие исследования позволили установить, что примером такой усложненной спирализации являются многие белковые молекулы и некоторые специализированные образования (в частности, жгутики бактерий).
Вторая причина заключается в следующем. Так как белки являются линейными полимерами (то есть полимерами, в которых мономеры не образуют боковых ответвлений), то их молекулы должны иметь значительную длину. На самом деле они значительно короче, чем этого можно ожидать из простого умножения числа аминокислот в белке на длину одной аминокислоты. Недоразумение легко устранимо, если предположить, что молекула может изгибаться по длине и свертываться в клубок. Это свертывание происходит не хаотично, а в определенных местах. Участки цепи могут соединяться друг с другом за счет химических связей, и это придает скрученной молекуле большую устойчивость.
Обычно это происходит по местам расположения в белке аминокислоты цистеина, изображающем строение рибонуклеазы. Такая свернутая структура молекулы белка носит специальное название — «третичная структура». Как видно, первичная, вторичная и третичная структура белков отражает различные уровни организации полимерной белковой молекулы.
