Когда в 1868 году молодому, но уже известному профессору Петербургского университета Дмитрию Ивановичу Менделееву было поручено читать курс неорганической химии, он столкнулся с тем, что в существовавших книгах по химии не только отсутствует система в изложении материала, но нет и материала, который следовало бы рекомендовать студентам для серьезного изучения этого предмета.
Появилась необходимость в создании фундаментального труда, который стал бы основой для глубокого изучения химии.
Менделеев взялся за написание такого труда, который он назвал «Основы химии». Работая над составлением «Основ химии», он понимал, что известные в то время химические элементы существуют не в отрыве друг от друга, а что между ними имеется связь, которую нужно найти и выразить в простой, но стройной системе.
Менделеев писал: «Предприняв составление руководства к химии, названного «Основы химии», я должен был остановиться на какой-нибудь системе простых тел, чтобы в распределении их не руководствоваться случайными, как бы инстинктивными побуждениями, а каким-либо определенно точным началом».
Упорно трудясь над этим «началом», Менделеев тщательно изучал свойства и атомные веса известных ему элементов.
Расположив химические элементы в порядке возрастания атомных весов, он установил, что через определенное число элементов свойства их повторяются.
Это означало, что те или иные свойства присущи не только какому-нибудь одному химическому элементу, обладающему определенным атомным весом. Аналогичными свойствами обладают и другие элементы, атомные веса которых больше, чем у данного элемента, на определенную величину.
Несмотря на многочисленные неясности и противоречия, Менделеев не сомневался, что им открыт общий закон природы — закон о периодической зависимости свойств элементов от их атомных весов. Это означает, что через определенные промежутки — периоды — индивидуальные свойства химических элементов повторяются.
Расположив все химические элементы в таблицу, иллюстрирующую открытый им периодический закон, Менделеев разослал 1 марта 1869 года некоторым русским и иностранным ученым отдельный листок, озаглавленный: «Опыт системы элементов, основанной на их атомном весе и химическом сходстве».
Это был первоначальный вариант периодической системы Менделеева, над которым великому русскому ученому пришлось еще много поработать.
Атомные веса некоторых химических элементов были ранее установлены неверно. Поэтому эти элементы не становились в те места, которые им надлежало занять в периодической системе. Твердо веря в правильность своей системы, Менделеев делает смелый и решительный вывод: атомные веса некоторых элементов (бериллий, торий, уран и др.) следует изменить. Изменяя их, он располагает эти элементы в своей системе в соответствии с их химическими свойствами.
Встретились и другие трудности.
Известные в то время химические свойства некоторых элементов (бор, рубидий, таллий) не позволяли поместить эти элементы в те места периодической системы, куда они должны были бы войти в соответствии с их атомными весами. Менделеев решил, что свойства этих элементов описаны неверно и нуждаются в проверке. Впоследствии уточнение свойств этих химических элементов полностью подтвердило правильность предположений великого ученого.
Когда долгий и упорный труд ученого воплотился в стройную периодическую систему элементов, в таблице оказались незаполненные места. Менделеев предсказал существование еще не открытых в то время элементов, которые должны были занять эти места в таблице, и одновременно с определением их приблизительных атомных весов предусмотрел для некоторых из них даже цвет и растворимость.
Ученые всего мира были удивлены смелыми выводами, которые сделал Менделеев. Но больше всего они поразились, когда были открыты некоторые новые химические элементы, предсказанные великим русским ученым.
Свойства этих элементов совпали с теми, которые Дмитрий Иванович вывел на основании своей периодической системы.
В настоящее время в периодической системе элементов Менделеева не осталось ни одного незаполненного места. Все клетки заняты соответствующими элементами. Более того, открыты новые элементы, которые располагаются в конце таблицы и расширяют ее, не нарушая общей стройности системы.
Посмотрите внимательно на периодическую систему элементов Менделеева.
Все элементы расположены по порядку номеров в семи горизонтальных рядах — периодах, которые разбиты вертикальными линиями на девять групп.
В первом периоде находятся всего 2 элемента — водород (Н) и гелий (Не), стоящие под номерами 1 и 2. Во втором и третьем периодах — по 8 химических элементов. В четвертом, пятом и шестом периодах — по 18. В седьмом периоде Менделеев поместил 6 элементов, из которых последним был уран.
В настоящее время открыто еще 8 элементов, входящих в семейство урана. Они получили название трансурановых элементов.
Элементы, расположенные друг под другом в вертикальных рядах, обладают близкими химическими свойствами. Свойства эти прежде всего выражены в одинаковой валентности, которую проявляют элементы данной группы при своем соединении с кислородом. Поэтому формулы высших солеобразующих окислов для элементов каждой группы одинаковы.
Так, например, щелочные металлы первой группы — литий, натрий, калий и др.— проявляют одну валентность. Их окислы имеют общую формулу R2O, где под знаком R обозначается любой элемент данной группы.
Щелочноземельные элементы второй группы — бериллий, магний, кальций, стронций и др. — проявляют две валентности, и их окислы выражаются формулой RO.
Галогены седьмой группы — фтор, хлор, бром и йод — проявляют при образовании кислородных соединений семь валентностей, и формулы их высших окислов записываются в виде R2O7.
Наивысшая валентность, которую может проявить данный элемент, соответствует номеру группы периодической системы, в которой он расположен.
Первым в шестой группе периодической системы, под номером 8, расположен кислород. Подсчитаем все стоящие впереди элементы. Их семь. Это водород с атомным весом 1, гелий — 4, литий, — 6,9, бериллий — 9, бор — 10,8, углерод — 12 и азот — 14. Атомный вес кислорода — 16. Он самый тяжелый из первых восьми элементов, а так как в периодической системе они расположены по возрастанию атомных весов, его порядковый номер, естественно, равен восьми.
Что означает порядковый номер элемента?
Для того чтобы ответить на этот вопрос, необходимо хотя бы кратко ознакомиться со строением атома.
В современном представлении атом любого элемента состоит из положительно заряженного ядра, вокруг которого вращаются отрицательно заряженные электроны.
Ядра различных элементов отличаются друг от друга числом входящих в них заряженных частиц. Положительно заряженные частицы носят название протонов.
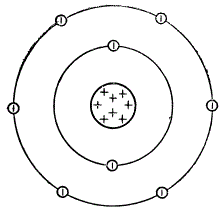
Упрощенная схема строения атома кислорода
В атоме водорода, который стоит под номером 1, всего лишь 1 протон; вокруг него вращается 1 электрон. Гелий стоит под номером 2. В ядре его атома 2 протона, и вокруг них вращаются 2 электрона. Третьим в периодической системе стоит литий; в его ядре 3 протона, вокруг которых вращаются 3 электрона. Под номером 8 расположен кислород. Ядро атома кислорода содержит Упрощенная схема строения 8 протонов, и вокруг этого атома кислорода, ядра вращаются 8 электронов.
Теперь уже нетрудно догадаться, что порядковый номер в периодической системе Менделеева равен числу протонов в ядре данного атома или числу электронов, вращающихся вокруг ядра. Это относится ко всем элементам, в том числе и к такому тяжелому элементу, как уран, порядковый номер которого равен 92. Ядро атома урана включает в себя 92 протона, вокруг которого на различных расстояниях, в различных направлениях движутся 92 электрона.
Электроны в атоме вращаются вокруг ядра, в определенном порядке, группами, в слоях, по-разному удаленных от ядра. Слоев в атоме может быть не больше восьми.
Химические свойства атомов определяются зарядом ядра и строением внешнего, последнего слоя атома. Чем число электронов на этом внешнем слое ближе к восьми, тем атом устойчивее.
Так как число электронов в атоме равно числу протонов, атомы электрически нейтральны, они не заряжены ни положительно, ни отрицательно.
Интересно было бы взглянуть на какой-нибудь атом через мощный микроскоп и посмотреть, как ведут себя в нем электроны и протоны. Но это сделать невозможно, так как нет и не может быть оптического микроскопа, в который можно было бы разглядеть частицы, размеры которых меньше длины волны видимого света.
Длина волны лучей видимого света равна примерно от 4 до 7 стотысячных сантиметра, а диаметр самого простого из всех атомов — атома водорода — равен одной стомиллионной сантиметра.
Как ни мала эта величина, однако она оказывается огромной по сравнению с ядром атома. Ядро атома водорода в 10 тысяч раз меньше самого атома.
Чтобы представить себе соотношение размеров и расстояний между ядром и электроном в атоме водорода, вообразите огромный пустой шар диаметром 50 метров. В центре этого шара находится свинцовая дробь диаметром 5 миллиметров, а по окружности с огромной скоростью, превышающей 200 километров в секунду, вращается полый алюминиевый шарик несколько большего размера.
Чем дальше от водорода стоит элемент в периодической системе Менделеева, тем сложнее строение его атома.
Размеры электронов и протонов близки друг другу, но массы их различны.
Масса электрона чрезвычайно мала — она равна 9, деленным на 10 000 000 000 000 000 000 000 000 000 граммов (9,1 X 10-28 граммов), а масса протона в 1840 раз больше. Поэтому вес атома определяется главным образом массой его протонов.
Если принять вес 1 атома водорода, состоящего из 1 протона и 1 электрона, за единицу, то вес атома, состоящего из 2 протонов и 2 электронов, должен быть в 2 раза больше, а вес атома, состоящего из 8 протонов и 8 электронов, должен быть в 8 раз больше, чем вес атома водорода.
Посмотрите еще раз на периодическую систему элементов Менделеева. Под номером 2 стоит элемент гелий, имеющий 2 протона. Его атомный вес равен 4. Он в 4 раза больше атомного веса водорода, а по нашим расчетам он должен быть больше только в 2 раза. Такое же несоответствие мы наблюдаем и у кислорода, расположенного в восьмой клетке. Атом кислорода оказывается в 16 раз тяжелее атома водорода, а не в 8, как это вытекает из сравнения числа протонов, входящих в состав их атомов. Не вкралась ли в наши представления об атоме ошибка? Нет, мы просто не всё еще узнали о строении атома.
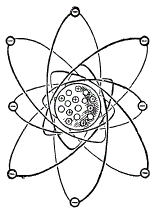
Схема атома кислорода
Ядра атомов водорода действительно состоят главным образом из одних протонов. Ядра атомов всех остальных элементов, кроме протонов, содержат еще и другие частицы — нейтроны.
Нейтроны электрически нейтральны, поэтому они не влияют на заряд атома. Но они влияют на атомный вес элемента, так как их масса примерно равна массе протонов. Таким образом, атомный вес складывается из массы всех протонов и нейтронов, входящих в ядро атома данного элемента.
Если атомный вес кислорода равен 16, а протонов в ядре 8, то нейтронов в ядре атома кислорода тоже 8. Следовательно, атом кислорода состоит из ядра, содержащего 8 протонов и 8 нейтронов, а вокруг этого ядра вращаются 8 электронов.
Вас, наверное, удивит, если вам скажут, что существует кислород с атомным весом 14, 15, 16, 17, 18 и 19. Это изотопы кислорода, которые встречаются в природе или могут быть получены искусственно.
Слово «изотоп» означает — занимать одно и то же место. Все изотопы одного элемента располагаются в системе элементов Менделеева под одним номером.
Химические свойства изотопов одного и того же элемента настолько близки, что разделить их даже самыми сложными химическими методами почти невозможно.
Это объясняется прежде всего тем, что заряды ядер и строение внешней электронной оболочки атомов изотопов одного и того же элемента совершенно одинаковы. В ядрах содержится одинаковое число протонов, вокруг которых вращается одинаковое число электронов. Изотопы отличаются лишь числом нейтронов в их ядрах.
В настоящее время точно установлено, что почти все элементы представляют собой смеси изотопов. Так, например, известны 3 изотопа водорода с атомными весами 1,2 и 3. Особенно интересен изотоп водорода с атомным весом 2. Он имеет свое особое название — дейтерий (D). Вода, в состав которой входит дейтерий, называется тяжелой водой (D2O). Тяжелая вода встречается в природе. Она входит в незначительном количестве в состав дождевой воды — на каждые 5 тонн ее приходится около килограмма.
Ядро изотопа водорода — дейтерия — содержит 1 протон и 1 нейтрон, а ядро изотопа водорода с атомным весом 3 — трития (Т) — состоит из 1 протона и 2 нейтронов.
Из чего же состоят ядра изотопов кислорода? Они, как и у обычного кислорода, имеют 8 протонов, а, следовательно, и 8 электронов вокруг ядра. В кислороде с атомным весом 14 (О14) имеется всего лишь 6 нейтронов, а с атомным весом 19 (О19) их насчитывается 11. Изотопы кислорода О14, О15, О19 неустойчивы, их ядра сами по себе разрушаются, переходя в атомы других элементов.
Самопроизвольный распад атомов идет обычно с выделением больших количеств энергии и носит название радиоактивности.
Время, за которое распадается половина взятого количества радиоактивного вещества, называется периодом полураспада или продолжительностью жизни данного элемента. Так, например, период полураспада изотопа О14 составляет 76,5 секунды. Это значит, что за это время распадается половина первоначального веса изотопа. Изотоп О15 живет 126 секунд, а изотоп О19 — 29,4 секунды. Кислород с атомным весом 17 и 18 довольно устойчив.
В обычном кислороде содержится 99,757 процента кислорода с атомным весом 16; 0,039 процента кислорода с атомным весом 17; 0,204 процента изотопа О18.
Вода, воздух, соли и другие соединения, в которые входит кислород, также содержат небольшое количество тяжелого кислорода О18. Но если увеличить процентное содержание О18 в обычном кислороде и приготовить из него воду, соли или газы, у которых процентное содержание тяжелого изотопа кислорода будет больше обычного, можно при помощи этих соединений проделать опыты, которые позволят раскрыть механизм отдельных процессов, протекающих в животных организмах, в природе или в лабораториях. Этим целям служат также некоторые радиоактивные элементы.
При распаде радиоактивных элементов выделяются невидимые лучи, которые действуют на фотопленку или фотопластинку, так же как рентгеновские лучи, при помощи которых делают снимки для выяснения различных заболеваний.
Ученые воспользовались радиоактивным излучением изотопов, чтобы выяснить, как распространяются различные вещества в живых организмах, с какой скоростью они продвигаются и в каких местах концентрируются. До применения радиоактивных элементов для ответа на такие вопросы надо было вскрыть подопытное животное или растение, нарушить жизненные функции живого организма. Теперь радиоактивные элементы помогают ученым сравнительно легко получать исчерпывающий ответ на эти вопросы.
Например, чтобы определить распространение фосфора в растении, его подкармливают радиоактивным изотопом этого элемента. Одновременно к растению подставляют фотопластинку, на которой фиксируются пути продвижения фосфора и места, в которых он концентрируется. Фотоснимок показывает, что фосфор собирается главным образом в корнях, почках и цветках растения.
Ученым также удалось определить скорость продвижения солей фосфора вдоль стебля растения. Оказывается, что соли фосфора продвигаются в растении со скоростью 10 сантиметров в час.
Естествоиспытателей давно интересовал вопрос о происхождении кислорода, выделяемого растениями при питании. Разрешить эту интересную проблему помог тяжелый изотоп кислорода с атомным весом 18.
