Кислотно-щелочная характеристика, или реакция, — это способность почв проявлять свойства кислот и щелочей при взаимодействии с водой или растворами солей. Мерой реакции почв является соотношение в почвенном растворе водородных (Н+) и гидроксильных (ОН—) ионов. Реакция почв характеризуется величиной pH — отрицательным логарифмом активности водородных ионов в растворах. Почвы могут иметь кислую (pH < 7), нейтральную (pH = 7) или щелочную (pH > 7) реакцию.
Различают два вида почвенной кислотности: актуальную и потенциальную, которая в свою очередь подразделяется на обменную и гидролитическую.
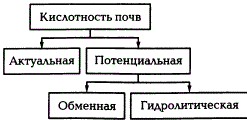
Виды кислотности почв
Актуальной кислотностью называется кислотность почвенного раствора. Она измеряется при взаимодействии почвы с дистиллированной водой (pHH2O). Актуальная кислотность зависит от наличия в почвенном растворе свободных органических и минеральных кислот (главным образом, угольной кислоты). Актуальная кислотность в почвах проявляется в диапазоне pH от 3 до 7.
Обменная кислотность обусловлена наличием в ППК обменных водорода и алюминия и определяется путем вытеснения ионов Н+ и Аl3+ раствором нейтральной соли КСl. Степень кислотности оценивают по величине pH солевой вытяжки. Обменная кислотность всегда больше актуальной. В почвах с ППК, насыщенны основаниями, обменная кислотность не определяется. Наиболее сильно она выражена в подзолистых почвах и краснозёмах. Существует четыре градации потенциальной кислотности почв, характеризуемой рНКСl.
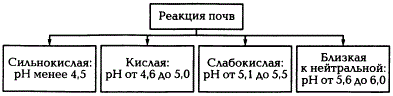
Градации кислотности почв
Гидролитическая кислотность определяется путем воздействия на почву гидролитически щелочной соли. При взаимодействии почвы с солью происходит более полное вытеснение из ППК обменных водорода и алюминия. Для определения гидролитической кислотности принято использовать 1,0 н. раствор CH3COONa. Он выражается в мг-экв на 100 г почвы.
По величине гидролитической кислотности (Н) находят необходимую для известкования почвы дозу извести и рассчитываю степень насыщенности почвы основаниями (V, %):
V= S / (S + Н) · 100%,
где S — сумма поглощенных оснований.
Почвы, обладающие кислотностью, распространены очень широко в бореальном поясе, а также в условиях влажных субтропиков и тропиков.
В Российской Федерации в конце XX в. кислые почвы занимал 51 млн га сельскохозяйственных угодий, в том числе 43 % всей пашни. Среди них преобладают сильно- и среднекислые почвы (рНКСl менее 5,0), площадь которых составляла 28 млн га. Во многих странах площади, занятые кислыми почвами, увеличиваются, и растет степень их кислотности. Причин тому несколько. Одна из них — внесение минеральных, часто физиологически кислых удобрений, не сопровождаемое необходимым известкованием.
Для многих, особенно промышленных, регионов характерно выпадение кислых и даже сильнокислых дождевых осадков с pH примерно 4,0—4,5, содержащих серную и частично азотную кис-лоты. Кислые дожди служат дополнительным фактором ускорения развития кислотности почв. В Нечерноземной зоне РФ потери СаCO3 в результате антропогенного подкисления почв достигают 400—450 кг/га в год.
Негативное влияние повышенной кислотности на растения обусловлено несколькими причинами, среди которых наибольшее значение имеют следующие:
- недостаток Са2+ — необходимого для растений элемента питания;
- повышенная концентрация ионов Аl3+, Мn2+, Н+;
- изменение доступности растениям макро — и микроэлементов питания;
- изменение физических свойств почвы.
От величины pH зависят подвижность и доступность растениям практически всех элементов питания. Усвояемость фосфора максимальна при pH = 6,5, снижаясь как в более кислой, так и в щелочной среде. Только в сильнощелочных почвах при pH около 9 и выше растворимость фосфатов вновь возрастает.
В кислых почвах повышается растворимость соединений железа, марганца, алюминия, бора, меди, цинка. При избытке этих элементов продуктивность растений снижается. В то же время высокая кислотность понижает доступность такого важного микроэлемента, как молибден.
Оптимальный интервал pH связан не только с растворимостью почвенных компонентов, но и с физиологическими особенностями возделываемых культур. Для одних растений оптимум pH лежит в интервале 4,0 — 5,0 (чайный куст, клюква), для других — от 6,0 до 8,0 (вишня, груша, орех грецкий, слива, яблоня). Для снижения поденной кислотности в качестве химических мелиорантов используют различные материалы. Наиболее употребительны осадочные породы, состоящие преимущественно из кальцита, доломита СаМn(СO3)2, доломитизированные известняки, мергели. Кроме того, применяют известковые туфы и различные промышленные отходы: дефекат (отход свеклосахарного производства), другие шлаки. В большинстве мелиорантов действующим веществом является СаСО3.
С химической точки зрения карбонат кальция является лучшим средством для снижения почвенной кислотности.
При внесении карбоната кальция в кислую почву происходят реакции:
ППКH2+ + СаСО3 → ППКСа2+ + Н2СО3 → ППКСа2+ + Н2О + CO2
ППКAl23+ + 3СаСО3 + 3Н2O → ППКСа32+ + 2Al(OH)3 + 3CO2
В результате этих реакций создаются наиболее благоприятные условия: почвенный поглощающий комплекс насыщается кальцием, а в почвенном растворе образуется слабая угольная кислота.
