Англичанин Джон Дальтон, как и большинство его соотечественников, был в восхищении от гения Ньютона. И полностью принял взгляды своего кумира на строение материи. Помните: «Бог вначале дал материи форму твердых, массивных, непроницаемых, подвижных частиц…»? Эти слова Ньютона Дальтон принял как заповедь.
Следуя учению Ньютона, он писал в своем сочинении «Новая система химической философии»: «Во всех химических исследованиях с полным основанием считается важной задачей определение относительного веса простых веществ, составляющих сложное. Из весов, пропорциональных массе атомов, можно было бы вывести относительные веса самих конечных частиц или атомов тел, что привело бы к установлению их числа или веса во многих других соединениях».
Дж. Дальтон — основатель химической атомистики
Смотрите, как интересно: Дальтон определенно считал, что атомы разных химических элементов имели различный вес. И по относительному количеству простого вещества, входящего в сложное соединение, он собирался эти атомные веса определять.
В то время в распоряжении химиков были уже результаты химических анализов некоторых газов, например: аммиака, двуокиси углерода, водяного пара и так далее. Но Дальтон не доверял тому, что сделано чужими руками. Он сам взялся за исследование этилена (в те годы он назывался «маслородным газом») и метана («углеродистого водорода» по старой номенклатуре) и нашел, что оба они состоят из углерода и водорода. Причем весовых количеств углерода, приходящихся на одну весовую часть водорода, в этилене было 5,7, а в метане — вдвое больше.
Такой наглядный результат привел его к мысли, что маслородный газ (этилен) образован соединением одного атома углерода с одним атомом водорода, а углеродистый водород (метан) получается в результате объединения одного атома углерода с двумя атомами водорода.
Ту же идею строения он распространил и на другие известные тогда газы. Получилось так.
Маслородный газ: 1 атом углерода + 1 атом водорода (вместо С2Н4 для этилена, как мы знаем о том сегодня).
Углеродистый водород: 1 атом углерода + 2 атома водорода (вместо СН4 для метана).
Аммиак: 1 атом азота + 1 атом водорода (вместо NH3).
Двуокись углерода: 1 атом углерода + 2 атома кислорода (что соответствовало действительности).
Вода: 1 атом кислорода + 1 атом водорода (вместо Н2О).
Зная отношение элементов в указанных соединениях и приняв атомный вес водорода за единицу, Дальтон вычислил веса атомов и «веса сложных атомов» и составил в 1805 году такую таблицу:
| Вещество | Атомные веса 1805 г. | Атомные веса по международной таблице 1971 г. |
| Водород | 1 | 1,0079 |
| Азот | 4,2 | 14,0067 |
| Углерод | 4,3 | 12,011 |
| Аммиак | 5,2 | |
| Кислород | 5,5 | 15,9994 |
| Вода | 6,5 | |
| Окись углерода | 9,8 | |
| Углеродистый водород | 6,3 | |
| Маслородный газ | 5,9 |
Конечно, значения, полученные Дальтоном, неточны. Он не мог еще представить себе правильно молекулы соединений. Но в принципе великая проблема связи атомистики с химией и превращения последней в количественную науку была решена.
Дальтон неоднократно пересматривал значения атомных весов основных элементов, уточнял их.
Для облегчения понимания своей атомной теории Дальтон ввел символы, обозначающие отдельные атомы разных элементов. Их соединение делало атомный состав сложных тел наглядным.

Работы Дальтона привлекли внимание не только в Англии, но и на континенте. Однако скромность и даже некоторая робость ученого в отношениях с людьми не дали ему возможности ни выдвинуться, ни извлечь из своей научной славы какие-то выгоды для себя. Он продолжал вести скромный образ жизни частного учителя, размышляя в свободные часы над трудами Ньютона и древних атомистов. Дальтон вступил в манчестерское литературно-философское общество и был деятельным его членом.
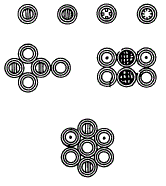
Символы элементов и соединений по Дальтону
Парижская академия наук одной из первых признала заслуги ученого-самоучки, избрав его иностранным членом. Лишь после этого отечественные университеты поднесли ему почетные дипломы. А король назначил пенсию…
Джон Дальтон до конца жизни оставался скромным тружеником науки, ни на один день не теряя главного свойства своего характера — жажды познания.
Взгляды Дальтона получили широкое распространение, прежде всего, потому, что они оказались очень своевременными. Однако немалую роль в их пропаганде сыграл химик Томас Томсон (1773—1832), известный в основном как историк химии.
Томсон был восторженным почитателем Дальтона. И хотя, как считают историки, «своим избыточным рвением Томсон принес делу больше вреда, чем помощи, потому что вследствие фатальной склонности к спекуляции он покидал иногда надежную почву точного исследования», тем не менее в распространение идей Дальтона Томсон внес, несомненно, большой вклад. Это очень важно, чтобы для научной теории вовремя нашелся хороший популяризатор.
Конечно, не все в теории Дальтона обстояло так хорошо, как казалось Томсону. Более того, в некоторых своих положениях английский химик шел даже на попятный по сравнению с уже высказанными идеями и предложениями других ученых.
Например, Дальтон не видел качественного различия между простыми и сложными атомами (молекулами), на которое обращал внимание еще Ломоносов. По мнению Дальтона, простые вещества вообще не могли состоять из сложных атомов (молекул). Эти ошибки привели его к большим неточностям в определениях атомных весов.
Нужно было срочно дополнить атомную гипотезу Дальтона представлениями о молекулах и найти способ точного определения атомного состава исследуемого элемента.
Джон Дальтон был сыном бедного ткача из Камберленда. Уже в детстве он проявлял такие способности к математике, что, когда ему исполнилось всего тринадцать лет, часто заменял учителя в своей школе. Однако семья его была настолько бедной, что в свободное от уроков время мальчик должен был искать дополнительные способы заработка.
В пятнадцать лет Джон поселился в небольшом городке Кендаль, где какой-то дальний родственник держал небольшую частную школу, и стал профессиональным учителем. За двенадцать лет пребывания в провинциальном городке Дальтон настолько пополнил свой багаж знаний, что отважился переехать в крупный промышленный Манчестер.
Он принял предложение занять место учителя математики и выступил в печати с работами, касающимися метеорологических явлений и дефекта зрения, которым страдал сам. В дальнейшем этот дефект получил название «дальтонизм».
Постепенно от наблюдений над метеорологическими явлениями он перешел к изучению газов. Он открыл закон парциальных давлений и заинтересовался вопросом об относительном весе частиц газа.
Закон Дальтона — один из основных газовых законов. Он гласит, что при постоянной температуре полное давление смеси нескольких химических невзаимодействующих газов равно сумме давлений всех составных частей смеси (сумме парциальных давлений).
В 1805 году французский химик Гей-Люссак доказал, что два объема водорода, соединяясь с одним объемом кислорода, давали два объема водяного пара, а не один, как следовало по теории Дальтона. Это требовало вдвое увеличить атомный вес кислорода.
Гей-Люссак не зря считался одним из самых выдающихся химиков своего богатого талантами столетия. Он ставит новые опыты: три объема водорода с одним объемом азота дают два объема аммиака, а не один, как получалось у Дальтона.
Несколько лет спустя Гей-Люссак обобщил свои исследования и сформулировал закон, согласно которому «газы всегда соединяются в простых объемных соотношениях, причем плотность газов пропорциональна принятым соединительным весам или простым кратным последних».
Узрев в законе Гей-Люссака помеху разрабатываемой им теории, Дальтон выступил против него, утверждая, что опыты французского исследователя неточны.
Атомистическая теория Дальтона требовала, чтобы в химических реакциях один атом вещества А соединялся с простым числом атомов вещества В. В этом и заключался его принцип образования сложных тел. А в объемах-то участвует огромное и вовсе не известное количество атомов газов. Как же тут быть?
Выход из создавшейся спорной ситуации нашел итальянский профессор физики Авогадро. Он первым понял, что если бы атомная теория Дальтона признала закон Гей-Люссака, то получилась бы истинная основа для химической науки. Для этого надо было только предположить, что одинаковые объемы различных газов, разумеется при постоянном давлении и температуре, содержат одинаковое количество частиц-молекул. Эта, поистине счастливая, мысль во многом способствовала пониманию законов, по которым происходили химические реакции.
Вспомните споры между Дальтоном и Гей-Люссаком по поводу соединения кислорода с водородом и образования воды…
Теперь, с помощью закона Авогадро, все становилось на свои места. Два объема водорода и должны были соединяться с одним объемом кислорода, чтобы образовать при этом два объема сложных молекул воды. Потому что отношения объемов отныне следовало считать не чем иным, как отношением между числом молекул, которые соединяются между собой и образуют более сложные молекулы.
Молекулярная теория Авогадро легко объясняла многие противоречивые факты, над которыми бились химики XIX века.
И все-таки в течение нескольких десятилетий она оставалась практически неизвестной европейским ученым. Одной из причин этой несправедливости является то, что увлеченным экспериментальными проблемами, которые были выдвинуты реформой Лавуазье, химикам было не до теоретических рассуждений, к которым они в то время даже не были как следует подготовлены. Да и само понятие молекулы было пока что чуждым для большинства практиков.
Долгое время химики путали атомы (Авогадро называл их «простыми или элементарными молекулами») и молекулы — частицы вещества (по Авогадро «составные молекулы»).
Рассказывали, что Амедео Авогадро ди Кваренья был человеком большой скромности. Он родился в 1776 году в Турине. Получил юридическое образование, но, испытывая большую склонность к точным наукам, изучил самостоятельно математику и физику и с 1820 года был профессором математической физики Туринского университета.
Многие его биографы соглашаются с тем, что в жизни Авогадро не было ничего внешне выдающегося. Единожды избрав свой путь, он посвятил себя науке. Современники отмечали его как превосходного профессора физики, любимого студентами и сотрудниками.
Авогадро не занимался экспериментами. Работая над основами молекулярной теории, он опирался на результаты опытов таких известных в то время химиков, как Гей-Люссак, Дюма и Берцелиус. Но это дало основание некоторым историкам упрекнуть ученого в том, что он высказывал лишь общие и абстрактные идеи о строении тел. Умер он в том же городе, в котором и родился, в 1856 году.
Четыре года спустя после смерти Авогадро Международный химический конгресс в Карлсруэ утвердил молекулярную гипотезу и окончательно сформулировал понятия атома и молекулы.
Отныне атомом в химии стали считать наименьшее количество элемента, входящего в состав минимально возможной частицы вещества, вступающей в химическую реакцию и носящей название молекулы. В том случае, когда молекулы были одноатомными, оба понятия совпадали.
В принятии молекулярной гипотезы сыграли большую роль не только новые опытные данные, полученные многими химиками, но и важные теоретические положения, высказанные главным образом французским химиком Ш. Жераром, а позднее итальянским химиком С. Канниццаро.
